Noutati
Comunicare directa catre profesionistii din domeniul sanatatii
LYNPARZA (olaparib): riscul aparitiei erorilor de medicatie asociate introducerii unei noi forme farmaceutice
LYNPARZA (olaparib): riscul aparitiei erorilor de medicatie asociate introducerii unei noi forme farmaceutice
Data: 14/03/2018
Stimate profesionist din domeniul sănătății,
De comun acord cu Agenția Europeană a Medicamentului (EMA) și Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale, compania AstraZeneca dorește să vă informeze cu privire la următoarele:
Rezumat
- Forma farmaceutică de comprimate a produsului LYNPARZA (olaparib) a fost aprobată de Comisia Europeană în <data deciziei Comisiei UE>.
- Capsulele și comprimatele de LYNPARZA nu se pot înlocui între ele folosind raportul 1 miligram per 1 miligram din cauza diferențelor referitoare la doze și biodisponibilitate ale fiecărei forme farmaceutice .
- Pentru a evita erorile de medicaţie, medicii prescriptori trebuie să specifice forma farmaceutică și doza de LYNPARZA pe fiecare rețetă, iar farmaciștii trebuie să se asigure că pacienților li se eliberează corect forma farmaceutică și doza recomandată.
- Instruiți pacienții cu privire la doza corectă pe care trebuie să o ia pentru capsule sau comprimate. Pentru toți pacienții care trec de la capsule la comprimate (sau invers), explicați modul în care dozele în miligrame pentru cele două forme farmaceutice sunt diferite.
LYNPARZA (olaparib), forma farmaceutică de comprimate este indicată în monoterapie ca tratament de întreținere la paciente adulte cu carcinom ovarian seros epitelial de grad înalt recidivat, neoplazie de trompă uterină sau neoplazie peritoneală primară, sensibile la medicamente pe bază de platină, cu răspuns (complet sau parțial) la chimioterapie pe bază de platină.
LYNPARZA (olaparib), forma farmaceutică de capsule este indicată în monoterapie ca tratament de întreținere la paciente adulte cu carcinom ovarian seros epitelial de grad înalt recidivat cu mutație BRCA (germinală și/sau somatică), neoplazie de trompă uterină sau neoplazie peritoneală primară, sensibile la medicamente pe bază de platină, cu răspuns (complet sau parțial) la chimioterapie pe bază de platină.
Modul de administrare pentru comprimate și capsule este diferit (a se vedea imaginea de mai jos) și cele două forme farmaceutice nu se pot înlocui între ele folosind raportul 1 miligram per 1 miligram; există un risc de supradozaj și de creștere a incidentei evenimentelor adverse dacă posologia pentru capsule este utilizată pentru comprimate sau lipsă de eficacitate dacă posologia pentru comprimate este utilizată pentru capsule.
| Concentrația, forma farmaceutică și ambalajul* |
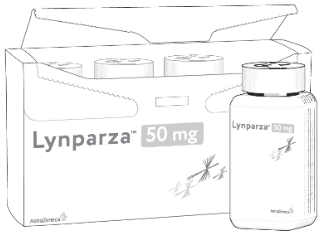 Capsule 50 mg |
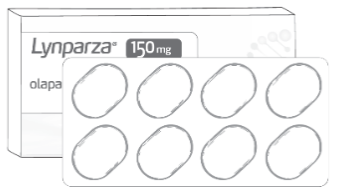 Comprimate 150 mg |
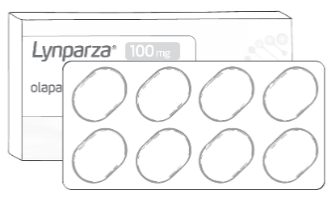 Comprimate 100 mg |
||
|
Doza recomandată 
|
400 mg de două ori pe zi Dimineața Seara |
300 mg de două ori pe zi Dimineața Seara |
Utilizată numai pentru reducerea dozei în tratamentul cu comprimate | ||
|
8 x |
8 x | 2 x | 2 x |
|
|
|
Doza zilnică totală: 800 mg |
Doza zilnică totală: 600 mg |
||||
|
Ajustarea dozei (de exemplu, în cazul apariţiei reacțiilor adverse) |
Reducerea dozei se obține utilizând mai puține capsule de 50 mg Scăderea inițială a dozei: 200 mg (4 capsule de 50 mg) de două ori pe zi (doza zilnică totală: 400 mg) Pentru scăderi suplimentare ale dozei: 100 mg (2 capsule de 50 mg) de două ori pe zi (doza zilnică totală: 200 mg) |
Reducerea dozei se obține utilizând comprimatele de 100 mg (a se vedea coloana alăturată) |
Reducerea inițială a dozei: 250 mg (1 comprimat de 150 mg și 1 comprimat de 100 mg) de două ori pe zi (doza zilnică totală: 500 mg) Pentru reduceri suplimentare ale dozei: 200 mg (2 comprimate de 100 mg) de două ori pe zi (doza zilnică totală: 400 mg) |
||
* Imaginile formulărilor formelor farmaceutice sunt doar reprezentări și nu sunt la scală.
Rezumatul caracteristicilor produsului, prospectul și ambalajul celor două forme farmaceutice ale LYNPARZA includ informații despre faptul că cele două forme farmaceutice nu se pot înlocui între ele folosind raportul 1 miligram per 1 miligram.
Acest medicament face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informații referitoare la siguranță. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate.
Apel la raportarea de reacţii adverse
Este important să raportaţi orice reacţie adversă suspectată, asociată cu administrarea medicamentului Lynparza, către Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale, în conformitate cu sistemul naţional de raportare spontană, utilizând formularele de raportare disponibile pe pagina web a Agenţiei Naţionale a Medicamentului şi a Dispozitivelor Medicale (www.anm.ro), la secţiunea Medicamente de uz uman/Raportează o reacţie adversă.
Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale
Str. Aviator Sănătescu nr. 48, sector 1
Bucureşti 011478- RO
Tel: + 4 021 317 11 02
Fax: +4 0213 163 497
E-mail: adr@anm.ro
www.anm.ro
Totodată, reacţiile adverse suspectate se pot raporta şi către reprezentanţa locală a deţinătorului autorizaţiei de punere pe piaţă, la următoarele date de contact:
AstraZeneca Pharma S.R.L.
Str. Menuetului, nr. 12, Bucharest Business Park
Corp D, etaj 1, 013713 Bucuresti
Fax: +4 021 317 60 55
Tel: +4 0730 111 113
Email: farmacovigilenta@astrazeneca.com
Coordonatele de contact ale reprezentanţei locale a Deţinătorului de autorizaţie de punere pe piaţă
Pentru întrebări suplimentare referitoare la medicamentul Lynparza, vă rugăm să contactați reprezentanța locală a deţinătorului autorizaţiei de punere pe piaţă, la următoarele date de contact:
AstraZeneca Pharma S.R.L.
Str. Menuetului, nr. 12, Bucharest Business Park
Corp D, etaj 1, 013713 Bucuresti
Fax: +4 021 317 60 55
Tel: +4 0730 111 113
Anexe
<Secțiunile relevante din informațiile despre produs care au fost revizuite (cu modificările făcute vizibile) >
NOUTATI!
11
APR
APR
01
APR
APR

